Механизмы лекарственного действия и резистентности (Фокус на Противомалярийных препаратах)
Перевод статьи - Mechanisms of Drug Action and Resistance (Focus on Antimalarials)
Автор - Mark F. Wiser
Источник оригинальной статьи:
Химиотерапия является основным средством лечения простейших инфекций. Успешная химиотерапия во многом зависит от способности использовать метаболические различия между возбудителем и хозяином. Проблема, связанная с химиотерапией, - это способность патогена мутировать и стать лекарственной. Конкретные примеры механизмов действия и сопротивления лекарственного средства обсуждаются ниже.
- Действие Лекарства
- Хлорохин и пищевая вакуоль
- Антифолаты
- Препараты окислительно-восстановительные механизмы
- Устойчивость к лекарству
- Хлорохин
- Другие ссылки
Aктивация препарата паразитом
| Селективная токсичность |
|---|
|
Препараты действуют определенно вмешиваясь в клеточные или биохимические процессы, часто названные 'целями'. Классицистический пример цели снадобья энзим который заблокирован снадобьем. Эффективные лекарства будут проявлять избирательную токсичность для патогена по сравнению с хозяином. Много факторов вносят вклад в эту выборочную токсичность (коробку) и эти факторы взаимно не исключительны. Рациональная конструкция снадобья изыскивает эксплуатировать эти различные факторы для того чтобы начать снадобья которые высоки токсические к патогену и в тоже время показывают минимальную токсичность к хозяину.
Хлорохин и пищевая Вакуоль
Вакуоль еды лизосом-как органелла в которой нервное расстройство гемоглобина и происходит детоксикация гема (см. более детальное обсуждение вакуоли еды). Хлорохин концентрируется до нескольких 1000 раз в пищевом вакуоле паразита. Возможные механизмы селективного накопления хлорохина в пищевой вакуоли являются: 1) протонирование и ионного захвата хлорохин из-за низкого рН пищевая вакуоль; 2) активное усвоение хлорохин паразитом транспортер(ов); и/или 3) обязательного хлорохина со специфическими рецепторами в пищевую вакуоль.
Точный вклад этих трех постулированных механизмов не ясен, но общепризнано, что хлорохин оказывает на него токсическое действие, препятствуя превращению свободного гема в гемозоин. Большое количество гема выделяется в результате переваривания гемоглобина в пищевой вакуоли. Свободный гем может лизировать мембраны, вести к поколению реактивных промежуточных звен кислорода, и блокирует много других процессов и таким образом довольно токсический. Гем детоксицируется в пищевой вакуоли с помощью процесса биокристаллизации, в котором гем секвестрируется в большие нерастворимые кристаллы, называемые гемозоин или малярийного пигмента. [См. более подробное описание образования гемозоина.] Точный механизм, с помощью которого хлорохин ингибирует образование гемозоина, неизвестен, но хлорохин может связывать гем, и это связывание может предотвратить включение гема в кристалл гемозина. Убийство паразита поэтому результат накопления метаболически отходов (например, гема) связанных с пищеварением гемоглобина.
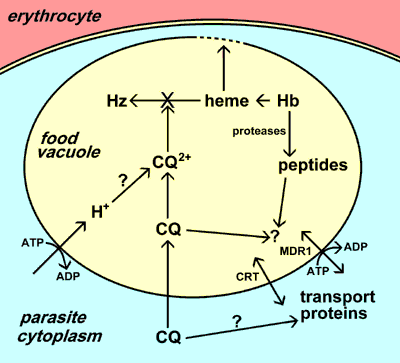
Хлорохин (CQ) накапливается в пищевом вакуоле паразита. Это накопление может включать захват ионов после протонирования, специфический транспорт и / или связывание с рецептором (например, гем.) Главное действие хлорохина заблокировать образование хемозоин (Hz) от гема выпущенного пищеварением гемоглобина (Hb). Свободный гем затем лизирует мембраны и приводит к гибели паразита. Устойчивость к хлорохину обусловлена уменьшением накопления хлорохина в пищевой вакуоли. В сопротивлении замешаны два разных транспортера (CRT и MDR1). Функции этих транспортеров и их точная роль в сопротивлении хлорохину неизвестны.
Другие хинолина, содержащие противомалярийных препаратов, например, мефлохином и хинином, также влияет на пищевой вакуоли. Однако, оно внутри не ясный связывают ли эти лекарства гем или влияют на образование хемозоин. Кроме того, эти снадобья более слабые основания чем хлорохин и не могут показать такую же степень запутывания Иона внутри вакуоль еды.
Вакуоль еды обеспечивает много потенциальных целей лекарства. В дополнение к ингибированию формирования гемозоин [малярийный пигмент] обсуждалось выше, специфические ингибиторы протеаз, участвующих в гемоглобина пищеварения в настоящее время также изучаются в качестве потенциальных противомалярийных препаратов. [См. более подробное обсуждение протеаз пищевого вакуоля.] Специализированные функции пищеварения гемоглобина и образования гемозоина уникальны для паразита и не встречаются в организме хозяина. Кроме того, обе функции-генерация аминокислот из гемоглобина и детоксикация гема-очень важны для паразита.
Антифолаты
Фолиевой метаболизм является мишенью нескольких противомалярийных препаратов, а также препаратов, применяемых против других патогенов. Уменьшенные фолаты служат сомножители в много реакций переноса ОДН-углерода, который включили в биосинтез аминокислот и нуклеотидов (см. больше на витаминах и сомножителях). Должный к своему высокому темпу репликации паразит малярии имеет высокий спрос для нуклеотидов как прекурсоры для синтеза ДНК (см. больше на нуклеотидах и нуклеиновых кислотах), и таким образом особенно чувствителен к антифолатам. Двумя первичными мишенями антифолитарного обмена являются биосинтез de novo фолатов и дигидрофолатредуктазы (DHFR).Малярийный паразит синтезирует фолаты de novo, в то время как человеческий хозяин должен получить предварительно сформированные фолаты и не может синтезировать фолат. Неспособность паразита использовать экзогенные фолаты делает биосинтез фолатов хорошей мишенью для лекарств. Фолат синтезируется из 3 основных строительных блоков-ГТФ, п-аминобензойной кислоты (паба) и глутамата-по пути, включающему 5 ферментов. Один из этих ферментов, дигидроптероат-синтаза (DHPS), ингибируется препаратами на основе сульфатов. Сульфадоксин и дапсон два основных противомалярийных препаратов, которые нацелены DHPS. Сульфидные препараты являются структурными аналогами pABA и превращаются в неметаболизируемые аддукты DHPS. Это приводит к истощению пула фолатов и тем самым уменьшает количество тимидилата, доступного для синтеза ДНК.
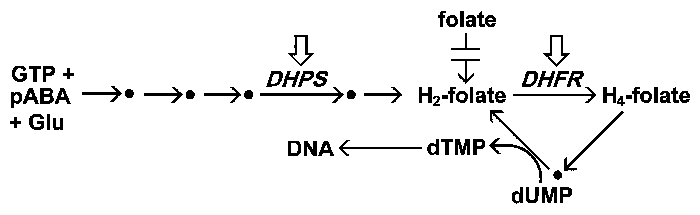
Упрощенная схема метаболизма фолатов. Малярийный паразит синтезирует фолаты de novo, но не может использовать предварительно сформированные фолаты. Фолаты участвуют как сомножители во многих биосинтетических процессах. Особого внимания заслуживает синтез тимидилата (dTMP), который необходим для синтеза ДНК. Две основные цели противомалярийных препаратов, которые нацелены на метаболизм фолата, обозначены стрелками в коробке.
DHFR является вездесущим ферментом, который участвует в рециркуляции фолатов путем восстановления дигидрофолата до тетрагидрофолата. В тетрагидрофолат затем окисляется обратно в дигидрофолат, так как он участвует в биосинтетических реакций (например, тимидилатсинтаза). Ингибирование DHFR предотвратит образование тимидилата и приведет к остановке синтеза ДНК и последующей смерти паразита. Пириметамин и прогуанил являются двумя наиболее распространенными ингибиторами DHFR, применяемыми в качестве противомалярийных препаратов. Эти лекарства блокируют DHFR от паразита в большей степени чем энзим хозяина и таким образом показывают выборочную токсичность к паразиту.
| Противовоспалительные комбинации | ||||||||
|---|---|---|---|---|---|---|---|---|
|
Чаще всего ингибиторы DHPS и DHFR применяются в комбинации (табл.) для получения синергетического эффекта и замедления развития лекарственной устойчивости. Перегласовки специфического пункта в этих энзимах водят к более низкому сродству для снадобиь. Резистентность имеет тенденцию быстро развиваться при наличии лекарственного давления в ситуациях, когда одна мутация может привести к лекарственной устойчивости. Использование комбинаций препаратов замедлит развитие резистентности, так как для развития резистентности к обоим препаратам должны произойти две независимые мутации. Фансидар, сочетание сульфадоксина и пириметамина, широко используется для лечения неосложненной малярии малярии. Триметоприм, похожие на пириметамин, широко используется в сочетании с другими сульфаниламидные препараты для лечения кокцидий (Toxoplasma, Cyclospora и Isospora) и Pneumocystis.
Препараты, Включающие Окислительно-Восстановительные Механизмы
Считается, что некоторые антипротозойные препараты действуют через оксидативный стресс (Таблица). Метаболически процессы произведут реактивные промежуточные звена (ROI) кислорода которые могут повредить клетчатые компоненты как липиды, протеины, и нуклеиновые кислоты (см. просмотрение на оксидативном усилии). Высокая метаболическая активность большинства патогенов протозоя приведет к еще более высокому уровню ROI. Примером этого является малярийный паразит, который производит ROI в результате переваривания гемоглобина и высвобождения свободного гема. [См. более подробное описание heme и ROI.] Все клетки имеют механизмы, с помощью которых ROI может быть детоксифицирован (например, окислительно-восстановительный метаболизм). Лекарства которые специфически увеличивают уровни оксидативного стресса в паразите могут сокрушить эти механизмы обороны рои и привести к смерти паразита. Уровни оксидативного стресса могут быть увеличены лекарствами которые сразу оксиданты, так же, как лекарствами которые участвовали в оксидоредукции задействуя, иногда вызванный бесполезный задействовать редоксов.
| Возможные Редокс-Агенты | ||||||||
|---|---|---|---|---|---|---|---|---|
|
Многие из препаратов, участвующих в окислительно-восстановительных реакциях, должны быть активированы до того, как они будут эффективны против своей цели(мишеней). Например, метронидазол и другие нитроимидазолы являются препаратами широкого спектра действия, которые влияют на широкий спектр анаэробных бактерий и простейших. Эти лекарства активированы уменьшением нитро группы к радикалу аниона. Анион-радикал является очень реакционноспособным и будет дополнять белки и ДНК, что приведет к потере функции. В частности, реакции с ДНК приводят к разрыву нити и ингибированию репликации и ведут к гибели клеток. Сокращение нитроимидазолов требует сильных восстановительных условий, а анаэробные организмы обладают меньшим потенциалом восстановления, чем аэробные организмы. Это объясняет селективность этих соединений для анаэробных организмов. Другими словами, лекарственные средства предпочтительно активируются патогенами.
В случае метронидазола основным донором электронов, ответственным за его восстановление, является восстановленный ферредоксин (Рис.). Существует хорошая корреляция между наличием пируват-ферредоксин-оксидоредуктазы (PFOR) и чувствительностью к метронидазолу. Все три простейших, пораженные метронидазолом (табл.), Не имеют митохондрий и имеют PFOR, сходные с таковыми у многих анаэробных бактерий. Аэробные организмы с митохондриями используют пируватдегидрогеназу вместо PFOR для производства ацетил-кофермента А.
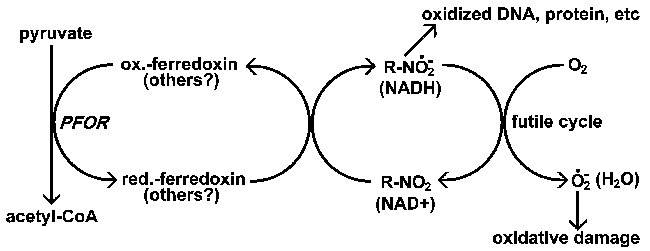
Действия нитроимидазолов. Нитроимидазолы (R-NO2) активируются паразитом через редукцию к анионному радикалу. Этот сильно реактивный радикал аниона после этого повредит ДНК и протеины приводящ в смерти паразита. Метронидазол, по-видимому, специфически восстанавливается ферредоксином в Giaridia, Entamoeba и Trichomonas. Аэробные организмы использовали бы другие доноры электронов для восстановления нитроимидазолов, а также была бы возможность установить бесполезные циклы, приводящие к генерации ROI, в которых кислород является конечным электронным акцептором. Обычно оксидоредуктазы NAD осуществляют окислительно-восстановительный цикл с конечным продуктом.
Нитроимидазолы (например, Бензнидазол) и родственные соединения нитрофуранового ряда (например, нифуртимокс) также являются эффективными против Trypanosoma cruzi. Доноры электронов, ответственные за первоначальное снижение этих препаратов АЕ, не известны и основа специфичности для паразита не ясна. Оба этих препарата несколько токсичны и не демонстрируют хороших терапевтических показателей. Поверены, что включает механизм действия нифуртимокс бесполезный редокс задействуя после своего уменьшения, тогда как бензнидизоле спекулировано для того чтобы заблокировать специфические редуктазы и таким образом уменьшить способность паразита извлечь рои.
Окислительный стресс и дефицит G6PD
Известно, что некоторые генетические заболевания человека обеспечивают определенную защиту от малярии (см. врожденная резистентность). Глюкозо-6-фосфатдегидрогеназы (Г6ФД) несовершенные люди будут иметь более низкие уровни восстановленного NADPH в эритроцитах, которая необходима для поддержания восстановленного глутатиона. Более низкие уровни уменьшенного глутатиона приведут в увеличенной чувствительности к оксидативному стрессу в виду того что пероксидаза глутатиона участвует в детоксикации ROI. Повышение уровня ROI из-за метаболизма паразита в сочетании с уменьшением способности G6PD-дефицитных эритроцитов удалять ROI приведет к преждевременному лизису инфицированного эритроцита и, следовательно, обеспечит некоторую защиту от малярии. Паразит не только должен защищать себя от ROI, но также должен гарантировать, что хозяин-эритроцит не будет поврежден до того, как паразит завершит эритроцитарную шизогонию. Фактически, было высказано предположение, что паразит может обеспечить эритроциты хозяина глутатионом для увеличения его восстановительной способности. В некоторой степени, примахин лечение противопоказано пациентам с дефицитом G6PD, поскольку это может вызвать гемолитическую анемию. Вероятно, это связано с способностью примахин генерировать ROI и уменьшением потенциала снижения эритроцитов с дефицитом G6PD.
Устойчивость к лекарству
| Механизмы сопротивления |
|---|
|
Появление лекарственной устойчивости серьезно ограничивает Арсенал доступных препаратов против простейших патогенов. Паразиты выработали многочисленные способы преодоления токсичности лекарственных средств (в рамке). Довольно часто устойчивость к лекарству вовлекает мутации в цель препарата так, чтобы препарат не связывал или запрещал цель также. Устойчивость к лекарственным препаратам может быстро развиваться в ситуациях, когда одноточечная мутация может придать устойчивость. Другой механизм лекарственной устойчивости включает в себя экспрессию более высоких уровней цели. Это может быть выполнено или через увеличенные транскрипцию и перевод или амплификацию Гена. Это приводит к требованию более высокого уровня лекарств для достижения такого же уровня ингибирования. Уменьшение накопления лекарственного средства или метаболизма лекарственного средства для нетоксичных продуктов приведет к тому, что меньшее количество лекарственного средства достигнет цели и может также способствовать резистентности к лекарственным средствам. Сопротивление лекарственным средствам также может включать накопление мутаций в тех же или разных целях, которые будут иметь аддитивные или синергические эффекты. Паразиты с мутациями или генетическими полиморфизмами, которые снижают чувствительность к лекарственным средствам, будут выбраны под давлением лекарственного средства.
| Белки и мутации, связанные с лекарственной устойчивостью | |||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
В некоторых случаях специфические мутации были связаны с лекарственной устойчивостью (Таблица). Фансидар (СП) сопротивление коррелирует с конкретными мутациями в ферментах, нацеленных на сульфадоксаун и пириметамин (дигидроптеротеситаза и дигидрофолатредуктаза соответственно). Устойчивость к хлорохину (более подробно обсуждается ниже) коррелирует с мутациями в переносчике, обнаруженном на мембране пищевой вакуоли (chloroquine resistance transporter, CRT). Подразумевается, что вспомогательную роль в резистентности играет еще один транспортер пищевой вакуоли-ген устойчивости к нескольким лекарственным препаратам 1 (MDR1). Основой для сопротивления мефлохином и хинином не понятно, но гена mdr1 также были вовлечены.
Хлорохин. Устойчивость к хлорохину связана со снижением количества хлорохина, который накапливается в пищевой вакуоли, месте действия хлорохина (см. выше). Механизм такого снижения накопления противоречив. Некоторые изучения показывали что уменшение в накоплении снадобья должно к увеличению утечки препарата. Тогда как другие изучения предлагают что умаленные уровни накопления хлорохина важне. Наблюдение, что верапамил и связанные с ним препараты могут обратить вспять устойчивый к хлорохину фенотип, привело к предположению, что зависимый от ATP транспортер играет определенную роль в лекарственном оттоке и устойчивости к хлорохину, подобно множественной лекарственной устойчивости (MDR) при раке. MDR-как транспортер, назначенный PfMDR1, был определен на пищевой мембраной вакуоль. Однако, нет однозначных корреляций между PfMDR1 и хлорохин сопротивления может быть продемонстрировано. Однако нельзя исключать вспомогательную роль PfMDR1 в устойчивости к хлорохину.
Генетический крест и анализа сопоставление между хлорохин устойчивостью клон и чувствительной клон хлорохин был выявлен у 36 Кб регион на хромосоме 7, связанные с хлорохину. Один из 10 генов в этой области 36 Кб кодирует белок с 10 трансмембранными доменами и напоминает белок-переносчик, похожий на хлоридные каналы. Ген был обозначен как pfcrt и протеин локализован к мембране вакуоли еды. Несколько перегласовок в гене pfcrt показывают корреляции с фенотипом сопротивления хлорохина и одна перегласовка, замещение треонина (Т) для лизина (К) на выпарке 76 (К76Т) показывает идеальную корреляцию с сопротивлением хлорохина. Предположительно эти мутации влияют на накопление хлорохина в пищевой вакуоли, но точный механизм устойчивости к хлорохину не известен. Кроме того, наблюдение, что устойчивость к хлорохину возникала относительно мало раз, а затем впоследствии распространялась, привело к предположению, что в развитии устойчивости участвуют несколько генов (см. более подробно).
Дополнительное чтение
- Foley M and Tilley L (1998) Quinoline antimalarials. Mechanisms of action and resistance and prospects for new agents. Pharmacology & Therapeutics 79:55
- Hyde JE (2007) Drug-resistant malaria -- an insight. FEBS Journal 274, 4688-4698.
- Ouellette M (2001) Biochemical and molecular mechanisms of drug resistance in parasites. Trop Med Int Health 6:874.
- Rosenthal PJ and Goldsmith RS (2001) Antiprotozoal drugs. In Basic and Clinical Pharmacology, 8th edition. McGraw-Hill Companies Inc. (On-line edition available through Stat!Ref Books at the Tulane Medical Library)
- Samuelson J (1999) Why metronidazole is active against both bacteria and parasites. Antimicrob Agents Chemother. 43:1533.
- Wellems TE and Plowe CV (2001) Chloroquine-resistant malaria. J Inf Dis 184:770.